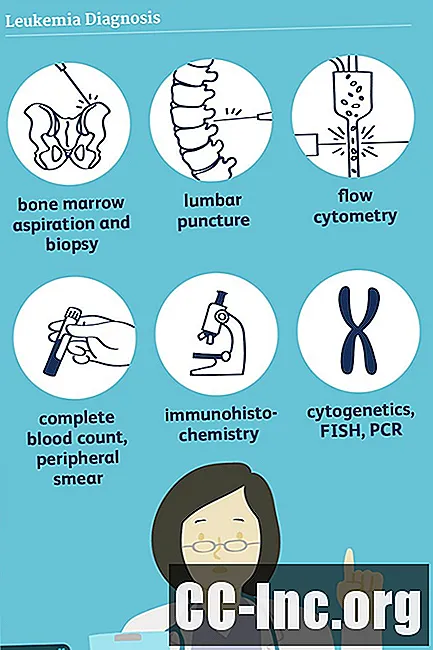
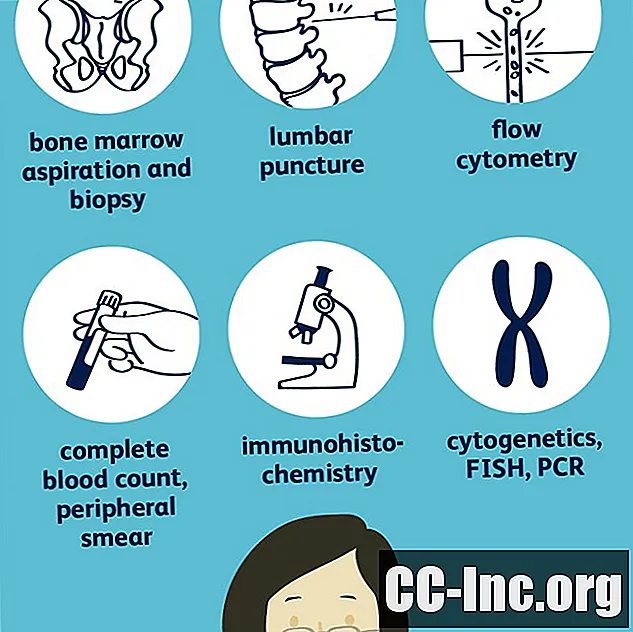
Contenu
- Examen physique et histoire
- Des analyses de sang
- Aspiration et biopsie de la moelle osseuse
- Cytochimie
- Études chromosomiques et géniques
- Autres procédures
- Imagerie
- Diagnostic différentiel
- Mise en scène
Des tests supplémentaires sont ensuite effectués pour rechercher des marqueurs de surface sur les cellules (cytométrie en flux) ainsi que des changements génétiques (tests cytogénétiques.) Avec certaines leucémies, une ponction lombaire (ponction lombaire) ou une biopsie des ganglions lymphatiques peuvent également être examinées.
Le cancer, s'il est détecté, est ensuite classé en fonction de facteurs tels que les symptômes, le sous-type de leucémie, le nombre de cellules anormales dans le sang ou la moelle osseuse, etc.
Lorsqu'on parle de diagnostic de leucémie, il est important de se rappeler que la leucémie n'est pas une maladie ni même quatre maladies. Au contraire, il existe de nombreuses variantes.
Deux leucémies qui semblent identiques au microscope peuvent se comporter très différemment, et certains des tests ci-dessous peuvent aider à distinguer certaines des différences.
Examen physique et histoire
L'anamnèse et le physique sont le point de départ du diagnostic de la leucémie et ce qui pousse souvent les médecins à commander des études complémentaires, mais ils ne peuvent être utilisés seuls pour poser le diagnostic.
Si une leucémie est suspectée, votre médecin vous posera des questions sur les symptômes de la leucémie et les facteurs de risque de la maladie que vous pourriez avoir. Un examen physique peut révéler des signes de leucémie, comme un gonflement des ganglions lymphatiques, une peau pâle ou des ecchymoses. Bien qu'ils soient notables s'ils sont présents, ils peuvent indiquer d'autres problèmes. Votre médecin tiendra compte de leur présence.
Guide de discussion pour les médecins spécialistes de la leucémie
Obtenez notre guide imprimable pour votre prochain rendez-vous chez le médecin pour vous aider à poser les bonnes questions.

Des analyses de sang
Une formule sanguine complète et un frottis périphérique, de simples tests sanguins, peuvent donner des indices importants quant au diagnostic et au type de leucémie, et guider une évaluation plus approfondie.
Numération complète des cellules sanguines et frottis sanguin périphérique
UNEnumération globulaire complète (CBC) mesure le nombre de chacun des principaux types de cellules sanguines produites par la moelle osseuse: les globules blancs, les globules rouges et les plaquettes. Le CBC peut également produire des résultats qui relaient des informations importantes sur ces cellules, par exemple si les globules rouges sont grands ou petits.
Bien qu'il y ait souvent une augmentation des globules blancs avec la leucémie, avec la leucémie aiguë, il y a parfois un diminution dans tous les types de cellules sanguines, une condition appelée pancytopénie.
UNE frottis périphérique est un test très important lors de l'examen du diagnostic de leucémie. Dans un frottis périphérique, un échantillon de sang est étalé sur une lame de microscope et un colorant est ajouté. Le frottis est ensuite évalué au microscope.
Un CBC peut déterminer si un nombre de globules blancs est bas ou élevé, mais ne donne pas suffisamment d'informations sur le type de globules blancs qui sont augmentés ou diminués.
Il ne dit pas non plus au médecin s'il y a des globules blancs immatures appelés «blastes» dans les cellules sanguines périphériques qui ne se trouvent normalement qu'en nombre significatif dans la moelle osseuse.
Un frottis périphérique peut répondre à ces questions en permettant aux techniciens et aux médecins d'observer directement les cellules au microscope.
Les résultats typiques (ceux-ci peuvent varier) sur un CBC et un frottis sanguin pour les quatre principaux types de leucémie comprennent:
Maladie | Résultats CBC | Résultats des frottis sanguins |
Leucémie myéloïde aiguë (LMA) | Des quantités inférieures à la normale de globules rouges et de plaquettes | De nombreux globules blancs immatures, et parfois la présence de bâtonnets Auer |
Leucémie lymphocytaire aiguë (LAL) | Des quantités inférieures à la normale de globules rouges et de plaquettes | De nombreux globules blancs immatures |
Leucémie myéloïde chronique (LMC) | • Le nombre de globules rouges peut être élevé et le nombre de plaquettes peut être élevé ou faible | • Peut montrer des globules blancs immatures |
Leucémie lymphoïde chronique (LLC) | • Les globules rouges et les plaquettes peuvent ou non être diminués | • Peu ou pas de globules blancs immatures |
Certains des tests décrits ci-dessous, tels que la cytochimie, peuvent également être effectués sur du sang périphérique.
Aspiration et biopsie de la moelle osseuse
Avec la plupart des types de leucémie, les tests sanguins ne suffisent pas pour diagnostiquer de manière concluante la maladie, et une ponction et une biopsie de la moelle osseuse sont effectuées. (Avec la LLC, le diagnostic peut parfois être posé sur la base des tests sanguins ci-dessus, mais une moelle osseuse peut toujours être utile pour déterminer le degré d'avancement du cancer.) La moelle osseuse est la source des cellules cancéreuses dans la leucémie et tous les cellules sanguines trouvées dans le sang périphérique.
Lors d'une aspiration de moelle osseuse, une aiguille longue et fine est insérée dans la moelle osseuse de la hanche (ou parfois du sternum) après avoir engourdi la peau localement avec de la lidocaïne. Après avoir aspiré un échantillon de moelle osseuse, un échantillon de biopsie est également prélevé.
Dans la moelle osseuse normale, entre 1 et 5% des cellules sont des cellules blastiques, ou des globules blancs immatures qui mûrissent en ceux que l'on trouve normalement dans le sang.
Un diagnostic de LAL peut être posé si au moins 20% des cellules sont des blastes (lymphoblastes). Avec la LMA, un diagnostic peut être posé s'il y a moins de 20% de blastes (myéloblastes) si un changement chromosomique spécifique est également trouvé.
En plus d'examiner le nombre de cellules différentes présentes dans la moelle osseuse, les médecins examinent également la configuration des cellules. Par exemple, avec la LLC, le pronostic de la maladie est meilleur si les cellules cancéreuses se trouvent en groupes (motif nodulaire ou interstitiel) que si elles se trouvent dispersées de manière diffuse autour de la moelle osseuse.
Le rapport des cellules leucémiques aux cellules hématopoïétiques saines peut être important dans le processus de diagnostic.
Cytochimie
La cytochimie examine comment les cellules de la moelle osseuse absorbent certaines taches et peut être utile pour distinguer ALL de la LMA. Les tests peuvent inclure à la fois la cytométrie en flux et l'immunohistochimie.
Dans cytométrie en flux, les cellules de la moelle osseuse (ou cellules sanguines périphériques) sont recouvertes d'anticorps pour rechercher la présence de certaines protéines trouvées à la surface des cellules. Les anticorps vont coller à ces protéines et peuvent être détectés par la lumière qu'ils dégagent lors de l'introduction d'un laser.
Immunohistochimie est similaire, mais au lieu d'utiliser un laser pour rechercher la lumière émise par des protéines marquées par des anticorps, elles peuvent être vues au microscope en raison d'un changement de couleur.
Ce processus de recherche de protéines uniques à la surface des cellules est appelé immunophénotypage. En génétique, le génotype fait référence aux caractéristiques d'un gène, tandis que le phénotype décrit des caractéristiques physiques (comme les yeux bleus). Différents types de leucémie diffèrent dans ces phénotypes.
Avec les leucémies aiguës (LAL et LAM), ces études peuvent être utiles pour déterminer le sous-type de la maladie, et avec la LAL, peuvent déterminer si la leucémie implique des cellules T ou des cellules B.
De plus, ces tests peuvent être très utiles pour confirmer un diagnostic de LLC (en recherchant des protéines appelées ZAP-70 et CD38).
La cytométrie en flux peut également être utilisée pour déterminer la quantité d'ADN dans les cellules leucémiques, ce qui peut être utile dans la planification du traitement. TOUTES les cellules qui ont plus d'ADN qu'une cellule moyenne ont tendance à mieux répondre à la chimiothérapie.
Études chromosomiques et géniques
Les cellules leucémiques présentent très souvent des modifications des chromosomes ou des gènes trouvés dans l'ADN de chaque cellule. Chacune de nos cellules a normalement 46 chromosomes, 23 de chaque parent, qui contiennent de nombreux gènes. Certaines études s'intéressent principalement aux changements chromosomiques, tandis que d'autres recherchent des changements dans des gènes spécifiques.
Cytogénétique
La cytogénétique consiste à visualiser les chromosomes des cellules cancéreuses au microscope et à rechercher des anomalies.
En raison de la méthode par laquelle cela est fait (les cellules cancéreuses ont besoin de temps pour se développer en laboratoire après avoir été récupérées), les résultats de ces études ne sont souvent pas disponibles pendant deux à trois semaines après une biopsie de la moelle osseuse.
Les changements chromosomiques qui peuvent être observés dans les cellules leucémiques comprennent:
- Délétions: une partie d'un chromosome est manquante.
- Translocations: Des morceaux de deux chromosomes sont échangés. Cela peut être un échange complet, dans lequel des morceaux d'ADN sont simplement échangés entre deux chromosomes, ou un chromosome partiel. Par exemple, l'ADN peut être permuté entre les chromosomes 9 et 22. Les translocations chromosomiques sont très courantes dans la leucémie, survenant dans jusqu'à 50 pour cent de ces cancers.
- Inversion: une partie d'un chromosome reste présente, mais est retournée (comme si une pièce d'un puzzle était retirée et remplacée, mais en arrière).
- Ajout ou duplication: des copies supplémentaires de tout ou partie d'un chromosome sont trouvées.
- Trisomie: Il existe trois copies de l'un des chromosomes, au lieu de deux.
En plus de définir davantage le type de leucémie, la cytogénétique peut aider à planifier le traitement. Par exemple, dans la LAL, les cellules leucémiques qui ont plus de 50 chromosomes répondent mieux au traitement.
Hybridation in situ fluorescente (FISH)
L'hybridation fluorescente in situ (FISH) est une procédure qui utilise des colorants spéciaux pour rechercher des changements dans les chromosomes qui ne peuvent pas être détectés au microscope, ou des changements dans des gènes spécifiques.
Avec la leucémie myéloïde chronique (LMC), ce test peut rechercher pièces du gène de fusion BCR / ABL1 (chromosome Philadelphie).
Environ 95% des personnes atteintes de LMC auront ce chromosome 22 raccourci, mais les 5% restants auront toujours le gène de fusion anormal BCR / ABL1 lors de tests supplémentaires. Le chromosome de Philadelphie est également une découverte importante avec la LAL.
Avec la LLC, la cytogénétique est moins utile, et la FISH et la PCR sont plus importantes pour trouver des changements génétiques.De nombreuses anomalies génétiques peuvent être observées dans ces études, y compris des délétions dans le bras long du chromosome 13 (chez la moitié des personnes atteintes de la maladie), une copie supplémentaire du chromosome 12 (trisomie 12), des délétions dans le 17e et le 11e chromosome et des mutations spécifiques dans des gènes tels que NOTCH1, SF3B1, etc.
Réaction en chaîne par polymérase (PCR)
Comme FISH, la réaction en chaîne par polymérase (PCR) peut détecter des changements dans les chromosomes et les gènes qui ne peuvent pas être vus par la cytogénétique. La PCR est également utile pour trouver des changements qui ne sont présents que dans quelques-unes, mais pas toutes, des cellules cancéreuses.
La PCR est très sensible pour trouver le gène BCR / ABL, même lorsque d'autres signes de LMC ne sont pas détectés lors des tests chromosomiques.
Autres procédures
En plus d'évaluer les globules blancs dans le sang et la moelle osseuse, d'autres procédures sont parfois effectuées.
Ponction lombaire (ponction lombaire)
Avec certains types de leucémie, une ponction lombaire (ponction lombaire) peut être effectuée pour rechercher la présence de cellules leucémiques qui se sont propagées dans le liquide entourant le cerveau et la moelle épinière. Cela peut également être fait pour les personnes atteintes de LAL. en tant que personnes atteintes de LMA qui présentent des symptômes neurologiques suggérant cette propagation.
Lors d'une ponction lombaire, une personne est allongée sur une table sur le côté, les genoux en l'air et la tête en bas. Après avoir nettoyé et engourdi la zone, un médecin insère une longue aiguille fine dans le bas du dos, entre les vertèbres et dans l'espace entourant la moelle épinière. Le liquide est ensuite prélevé et envoyé à un pathologiste pour être analysé.
Biopsie des ganglions lymphatiques
Les biopsies des ganglions lymphatiques, au cours desquelles une partie ou la totalité d'un ganglion lymphatique est prélevée, sont rarement effectuées avec la leucémie. un lymphome.
Imagerie
Les tests d'imagerie ne sont généralement pas utilisés comme méthode de diagnostic de la leucémie, car les cancers liés au sang comme la leucémie ne forment pas souvent des tumeurs. Il peut cependant être utile pour la stadification de certaines leucémies, comme la LLC.
Rayons X
Les rayons X, comme une radiographie pulmonaire ou une radiographie osseuse, ne sont pas utilisés pour diagnostiquer la leucémie, mais peuvent donner les premiers signes que quelque chose ne va pas. Une radiographie peut montrer une hypertrophie des ganglions lymphatiques ou un amincissement des os (ostéopénie).
Tomographie assistée par ordinateur (tomodensitométrie)
Un scanner utilise une série de rayons X pour créer une image tridimensionnelle de l'intérieur du corps. La tomodensitométrie peut être utile pour examiner les ganglions de la poitrine ou d'autres régions du corps, ainsi que pour noter une hypertrophie de la rate ou du foie.
Imagerie par résonance magnétique (IRM)
Une IRM utilise des aimants pour créer une image de l'intérieur du corps et n'implique pas de rayonnement. Il peut être utile dans les leucémies qui touchent le cerveau ou la moelle épinière.
Tomographie par émission de positrons (TEP / CT ou TEP / IRM)
Lors d'un TEP, du glucose radioactif est injecté dans le corps, où il est absorbé par des cellules plus métaboliquement actives (comme les cellules cancéreuses). La TEP est plus utile avec les tumeurs solides qu'avec la leucémie, mais peut être utile avec certaines leucémies chroniques, en particulier lorsqu'il y a des inquiétudes concernant la transformation en lymphome.
Diagnostic différentiel
Certaines maladies, au moins avec les tests initiaux, peuvent ressembler à la leucémie. Certains d'entre eux incluent:
- Certaines infections virales: par exemple, le virus d'Epstein-Barr (la cause de la mononucléose infectieuse), le cytomégalovirus et le VIH peuvent provoquer un nombre élevé de lymphocytes atypiques lors de tests sanguins.
- Syndromes myélodysplasiques: Ce sont des maladies de la moelle osseuse qui ont une prédilection pour se développer en AML et sont parfois appelées préleucémie.
- Troubles myéloprolifératifs: des conditions telles que la polyglobulie, la thrombocytose essentielle, la myélofibrose primaire, etc. peuvent ressembler à une leucémie avant l'exécution des méthodes de test approfondies ci-dessus.
- Anémie aplasique: état dans lequel la moelle osseuse cesse de produire tous les types de cellules sanguines.
Mise en scène
Une fois la leucémie confirmée, elle doit être échelonnée. La stadification fait référence au système utilisé par les médecins pour catégoriser un cancer. Déterminer le stade d'un cancer, en général, peut aider les médecins à choisir le traitement le plus approprié ainsi qu'à estimer le pronostic de la maladie.
La stadification diffère entre les différents types de leucémie. Étant donné que de nombreuses leucémies ne forment pas de masses solides, la stadification (à l'exception de la LLC) est très différente de celle des tumeurs solides telles que le cancer du sein ou le cancer du poumon.
Un certain nombre d'études peuvent être prises en compte pour attribuer un stade, comme le nombre de globules blancs immatures trouvés dans le sang ou la moelle osseuse, les marqueurs tumoraux, les études chromosomiques, etc.
Lorsqu'on regarde la stadification, il est encore une fois important de noter que la leucémie est un large éventail de maladies. Deux personnes atteintes du même type de leucémie et au même stade peuvent avoir des réponses très différentes au traitement, ainsi que des pronostics différents.
Leucémie lymphoïde chronique (LLC)
Pour la leucémie lymphoïde chronique, il existe un certain nombre de systèmes de stadification différents qui peuvent être utilisés. Le système Rai est le plus courant. Dans ce système, les leucémies se voient attribuer un stade entre le stade 0 et le stade 4 en fonction de la présence de plusieurs résultats:
- Nombre élevé de lymphocytes
- Ganglions lymphatiques élargis
- Une hypertrophie du foie et / ou de la rate
- Anémie
- Faible taux de plaquettes
Sur la base de ces stades, les cancers sont ensuite séparés en catégories de risque faible, intermédiaire et élevé.
En revanche, le système Binet utilisé en Europe sépare ces leucémies en seulement trois étapes:
- Stade A: moins de 3 ganglions lymphatiques
- Stade B: plus de 3 ganglions lymphatiques affectés
- Stade C: N'importe quel nombre de ganglions lymphatiques, mais combiné à une anémie ou à un faible taux de plaquettes.
Leucémie lymphocytaire aiguë (LAL)
Pour la leucémie lymphocytaire aiguë, la stadification est différente, car la maladie ne forme pas de masses tumorales qui s'étendent progressivement à partir d'une tumeur d'origine.
La LAL se propage probablement à d'autres organes avant même qu'elle ne soit détectée, donc plutôt que d'utiliser des méthodes de stadification traditionnelles, les médecins prennent souvent en compte le sous-type de LAL et l'âge de la personne.
Cela implique généralement des tests cytogénétiques, une cytométrie en flux et d'autres tests de laboratoire.
Plutôt que d'utiliser des stades (ceux utilisés dans le passé sont largement obsolètes), la LAL est plus souvent définie par les «phases» de la maladie. Ceux-ci incluent:
- TOUT non traité
- TOUS en rémission
- Maladie résiduelle minime
- Réfractaire ALL
- Récidive (récurrente) TOUS
Leucémie myéloïde aiguë (LMA)
Semblable à la LAL, la leucémie myéloïde aiguë n'est généralement pas détectée tant qu'elle ne s'est pas propagée à d'autres organes, et la stadification traditionnelle du cancer n'est donc pas applicable. La stadification est déterminée par des caractéristiques telles que le sous-type de leucémie, l'âge d'une personne, etc.
Un système de classification plus ancien, la classification franco-américaine-britannique (FAB), classait la LMA en huit sous-types, M0 à M7, en fonction de l'apparence des cellules au microscope.
L'Organisation mondiale de la santé (OMS) a développé un système différent pour la stadification de la LMA dans l'espoir de prédire plus étroitement le pronostic de la maladie.
Dans ce système, ces leucémies sont séparées par des caractéristiques telles que des anomalies chromosomiques dans les cellules (certaines modifications chromosomiques sont associées à un pronostic meilleur que la moyenne, tandis que d'autres sont associées à des résultats moins bons), que le cancer soit apparu après une chimiothérapie antérieure ou les radiations (cancers secondaires), ceux liés au syndrome de Down, etc.
Leucémie myéloïde chronique (LMC)
Pour la leucémie myéloïde chronique, la présence d'un nombre accru de cellules matures appartenant à la lignée myéloïde (comme les neutrophiles) est courante. La stadification est déterminée en fonction du nombre de cellules myéloïdes immatures à différents stades de maturation:
- Phase chronique: À ce stade le plus précoce, il y a moins de 10 pour cent de blastes dans le sang ou la moelle osseuse et les symptômes sont légers ou absents. Les personnes en phase chronique de LMC répondent généralement bien au traitement.
- Phase accélérée: dans la phase suivante, 10 à 20% des cellules du sang ou de la moelle osseuse sont des blastes. Les symptômes deviennent plus prononcés, en particulier la fièvre et la perte de poids. Les tests peuvent révéler de nouveaux changements chromosomiques en plus du chromosome Philadelphie. Les personnes en phase accélérée de LMC peuvent ne pas répondre au traitement.
- Phase blastique (phase agressive): Dans la phase blastique de la LMC, plus de 20% des cellules du sang ou de la moelle osseuse sont des blastes, et les cellules blastiques peuvent également se propager à des zones du corps en dehors de la moelle osseuse. Au cours de cette phase, les symptômes comprennent la fatigue, la fièvre et une rate hypertrophiée (crise blastique).