Contenu
- Cancer du sein héréditaire
- Mutations géniques non BRCA
- Cancer du sein et tests génétiques
- Soutien au cancer du sein héréditaire
En plus des mutations des gènes BRCA1 et BRCA2, certaines d'entre elles incluent des mutations dans ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2, etc. Regardons à quel point ces mutations non-BRCA1 / BRCA2 sont importantes dans le cancer du sein familial, et certaines des caractéristiques de celles qui sont le plus souvent trouvées.
Cancer du sein héréditaire
On pense actuellement que 5 à 10% des cancers du sein sont génétiques ou familiaux (bien que ce nombre puisse changer à mesure que nous en apprenons plus), mais tous ces cancers ne sont pas dus à des mutations BRCA.
Tout au plus, 29% (et probablement beaucoup moins) de cancers du sein héréditaires sont testés positifs pour les mutations génétiques BRCA1 ou BRCA2, et de nombreuses personnes poursuivent des tests pour les autres changements génétiques connus.
Étant donné que la science derrière le cancer héréditaire est très anxiogène, sans parler de confusion et incomplète, il est utile de commencer par parler de la biologie des mutations génétiques et de la manière dont ces changements dans l'ADN jouent un rôle dans le développement du cancer.
Mutations génétiques héritées ou acquises
Lorsqu'on parle de mutations, il est important de faire la distinction entre les mutations génétiques héritées et acquises.
Les mutations génétiques acquises ou somatiques ont reçu beaucoup d'attention ces dernières années, car ces mutations provoquent des changements qui entraînent la croissance du cancer. Les thérapies ciblées, médicaments qui ciblent des voies spécifiques liées à ces changements, ont considérablement amélioré le traitement de certains cancers comme le cancer du poumon.
Les mutations acquises, cependant, ne sont pas présentes dès la naissance, mais se forment à tout moment après la naissance au cours du processus d'une cellule devenant une cellule cancéreuse. Ces mutations n'affectent que certaines cellules du corps. Ils ne sont pas hérités d'un parent, mais plutôt «acquis» car l'ADN des cellules est exposé aux dommages causés par l'environnement ou à la suite des processus métaboliques normaux du corps.
Les mutations héréditaires ou germinales, en revanche, sont des changements génétiques avec lesquels les gens naissent et qui sont transmis par un ou les deux parents. Ces mutations affectent toutes les cellules du corps. Ce sont ces mutations héréditaires (et d'autres changements génétiques) qui peuvent augmenter le risque qu'une personne développe un cancer et expliquent ce que l'on appelle le cancer du sein héréditaire ou familial.
Mutations génétiques héréditaires (lignée germinale) vs acquises (somatiques)Comment les mutations génétiques héréditaires augmentent-elles le risque de cancer?
Beaucoup de gens se demandent comment exactement un gène anormal ou des combinaisons de gènes pourraient conduire au cancer du sein, et une brève discussion sur la biologie est utile pour comprendre de nombreuses questions, comme pourquoi toutes les personnes atteintes de ces mutations ne développent pas un cancer.
Notre ADN est un modèle ou un code utilisé pour fabriquer des protéines. Lorsque la carte ou le code est erroné (comme le «lettrage» dans un gène particulier), cela donne les mauvaises directions pour synthétiser une protéine. La protéine anormale est alors incapable d'accomplir son travail habituel. Toutes les mutations génétiques n'augmentent pas le risque de cancer, et en fait, la plupart ne le font pas. Les mutations dans les gènes responsables de la croissance et de la division des cellules, ou «mutations conductrices», sont ce qui motive la croissance des cancers. Il existe deux principaux types de gènes qui, lorsqu'ils sont mutés, peuvent entraîner une croissance incontrôlée appelée cancer: les oncogènes et les gènes suppresseurs de tumeurs.
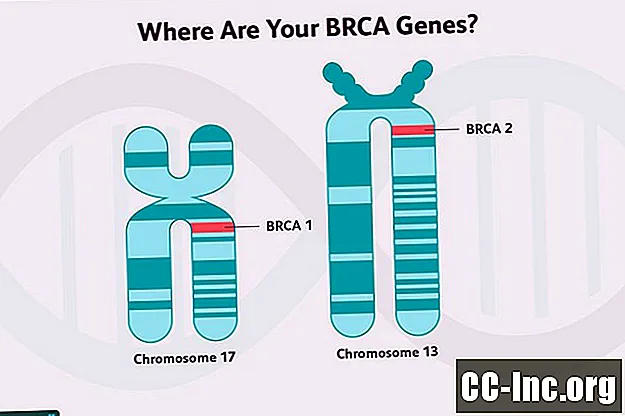
Plusieurs des gènes associés à un risque plus élevé de cancer du sein sont des gènes suppresseurs de tumeur. Ces gènes codent pour des protéines qui fonctionnent pour réparer les dommages causés à l'ADN dans les cellules (dommages causés par les toxines dans l'environnement ou les processus métaboliques normaux dans les cellules), servent à éliminer les cellules qui ne peuvent pas être réparées ou à réguler la croissance par d'autres moyens. Les gènes BRCA1 et BRCA2 sont des gènes suppresseurs de tumeurs.
Beaucoup de ces gènes sont autosomiques récessifs, ce qui signifie que chaque personne hérite d'une copie du gène de chaque parent, et les deux copies doivent être mutées pour augmenter le risque de cancer. De manière simpliste, cela signifie qu'une combinaison de facteurs génétiques et environnementaux (une mutation acquise dans l'autre gène) doit agir ensemble pour entraîner le développement d'un cancer. Ajouté à cela, généralement, plusieurs mutations doivent se produire pour qu'une cellule devienne une cellule cancéreuse.
Ce que signifie avoir une prédisposition génétique au cancerPénétrance des gènes
Toutes les mutations génétiques ou changements génétiques n'augmentent pas au même degré le risque de cancer du sein, et c'est un concept important pour quiconque envisage des tests génétiques, d'autant plus que de nombreuses personnes ont entendu parler du risque très élevé conféré par les mutations BRCA. La pénétrance génique est définie comme la proportion de personnes ayant une mutation qui souffriront de la maladie (dans ce cas, développeront un cancer du sein).
Pour certaines mutations, le risque de cancer du sein est très élevé. Pour d'autres, le risque ne peut être augmenté que d'un facteur 1,5. Il est important de comprendre cela lorsque l'on parle d'options préventives possibles.
Épigénétique
Un autre concept important pour comprendre la génétique et le cancer, bien que trop complexe pour être approfondi ici, est celui de l'épigénétique. Nous avons appris que les changements dans l'ADN qui n'impliquent pas de changements dans les paires de bases (nucléotides) ou les «lettres» qui codent pour une protéine, peuvent être tout aussi importants dans le développement du cancer. En d'autres termes, au lieu de changements structurels dans le squelette de l'ADN, il peut y avoir des changements moléculaires qui changent la façon dont le message est lu ou exprimé.
Mutations géniques non BRCA
Les mutations du gène BRCA sont l'anomalie génétique la plus connue associée au cancer du sein, mais il est clair qu'il existe des femmes prédisposées au cancer du sein en raison de leurs antécédents familiaux, dont le test est négatif.
Une étude de 2017 a révélé que les mutations BRCA ne représentaient que 9 à 29% des cancers du sein héréditaires. Même lorsque des tests ont été effectués pour 20 à 40 autres mutations connues, cependant, seulement 4 à 11% des femmes ont été testées positives. En d'autres termes, 64% à 86% des femmes soupçonnées d'avoir un cancer du sein héréditaire ont été testées négatives pour les mutations BRCA et 20 à 40 autres.
Cancer du sein familial non BRCA1 / BRCA2
Nos connaissances sur les mutations génétiques qui augmentent le risque de cancer du sein sont encore incomplètes, mais nous savons maintenant qu'il existe au moins 72 mutations génétiques liées au cancer du sein héréditaire. On pense que ces mutations (et d'autres encore non découvertes) sont responsables des 70 à 90% des cancers du sein héréditaires dont le test est négatif pour les mutations du gène BRCA. L'acronyme BRCAX a été inventé pour décrire ces autres mutations, signifiant non- BRCA1 Cancer du sein familial lié à BRCA2.
72 mutations génétiques liées au cancer du sein héréditaireLes anomalies génétiques ci-dessous diffèrent par leur fréquence, le niveau de risque associé, le type de cancer du sein auquel elles sont liées et d'autres cancers associés aux mutations.
La plupart de ces cancers du sein ont des caractéristiques similaires (comme le type de cancer, le statut des récepteurs aux œstrogènes et le statut HER2) aux cancers du sein non héréditaires ou sporadiques, mais il existe des exceptions. Par exemple, certaines mutations sont plus fortement associées au cancer du sein triple négatif, y compris des mutations BARD1, BRCA1, BRCA2, PALB2, etRAD51D.
Variabilité au sein des mutations
Toutes les personnes qui ont les mutations génétiques suivantes ne sont pas identiques. En général, il peut y avoir des centaines de façons dont ces gènes sont mutés. Dans certains cas, le gène produira des protéines qui suppriment la croissance tumorale, mais les protéines ne fonctionneront pas aussi bien que la protéine normale. Avec d'autres mutations, la protéine peut ne pas être produite du tout.
BRCA (Bref examen pour comparaison)
Les mutations du gène BRCA 1 et les mutations du gène BRCA2 sont toutes deux associées à un risque accru de développer un cancer du sein, ainsi que certains autres cancers, bien que les deux diffèrent quelque peu dans ce risque.
En moyenne, 72% des femmes qui ont des mutations BRCA1 et 69% qui ont des gènes BRCA2 mutés développeront un cancer du sein à l'âge de 80 ans.
De plus, les cancers du sein associés à ces mutations peuvent différer. Les cancers du sein chez les femmes qui ont des mutations BRCA1 sont plus susceptibles d'être triplement négatifs. Environ 75 pour cent sont des récepteurs aux œstrogènes négatifs et ils sont également moins susceptibles d'être HER2 positifs. Ils sont également plus susceptibles d'avoir un grade tumoral plus élevé. Les cancers du sein chez les femmes présentant des mutations BRCA2, en revanche, sont similaires aux cancers chez les femmes qui ne sont pas porteuses de mutations du gène BRCA.
Gène ATM (sérine ATM / thréonine kinase)
Le gène ATM code pour des protéines qui aident à contrôler le taux de croissance des cellules. Ils aident également à la réparation des cellules endommagées (cellules qui ont subi des dommages à l'ADN causés par des toxines) en activant des enzymes qui réparent ces dommages.
Ceux qui ont deux copies du gène muté ont un syndrome autosomique récessif rare appelé ataxie-télangiectasie. Avec l'ataxie-télangiectasie, les protéines défectueuses non seulement augmentent le risque de cancer, mais entraînent la mort prématurée de certaines cellules du cerveau, entraînant une maladie neurodégénérative progressive.
Les personnes qui n'ont qu'une seule copie mutée du gène (environ 1 pour cent de la population) ont un risque à vie de 20 à 60 pour cent de développer un cancer du sein.
On pense que les personnes qui ont cette mutation sont prédisposées au cancer du sein à un âge précoce, ainsi qu'au développement d'un cancer du sein bilatéral.
Le dépistage du cancer du sein par IRM mammaire est recommandé à partir de 40 ans et les femmes peuvent envisager des mastectomies préventives. Les personnes porteuses d'un gène ATM muté semblent également prédisposées aux cancers de la thyroïde et du pancréas et sont plus sensibles aux radiations.
PALB2
Les mutations du gène PALB2 sont également une cause importante de cancer du sein héréditaire. Le gène PALB2 code pour une protéine qui fonctionne conjointement avec la protéine BRCA2 pour réparer l'ADN endommagé dans les cellules. Dans l'ensemble, le risque à vie de cancer du sein avec une mutation PALB2 est aussi élevé que 58 pour cent, bien que cela puisse varier selon l'âge. Le risque est de 8 à 9 fois la moyenne pour les femmes de moins de 40 ans, mais environ 5 fois la moyenne pour les femmes de plus de 60 ans.
Parmi ceux qui portent une copie du gène, 14% développeront un cancer du sein à 50 ans et 35% à 70 ans (moins qu'avec les mutations BRCA).
Les personnes qui ont une mutation PALB2 et développent un cancer du sein peuvent avoir un risque plus élevé de mourir de la maladie.
Les personnes qui héritent de 2 copies du gène PALB2 muté ont un type d'anémie de Fanconi caractérisé par un très faible nombre de globules rouges, de globules blancs et de plaquettes.
CHEK2
Le gène CHEK2 code pour une protéine qui est activée lorsque l'ADN est endommagé. Il active également d'autres gènes impliqués dans la réparation cellulaire.
Les risques à vie pour les porteurs de mutations tronquantes CHEK2 sont de 20 pour cent pour une femme sans parent atteint, 28 pour cent pour une femme avec un parent au deuxième degré touché, 34 pour cent pour une femme avec un parent au premier degré touché, et 44 pour cent pour une femme affectée à la fois par un parent du premier et du deuxième degré.
Pour les hommes et les femmes, le gène augmente également le risque de cancer du côlon et de lymphome non hodgkinien.
CDH1
Les mutations de CDH1 provoquent une maladie connue sous le nom de syndrome de cancer gastrique héréditaire.
Les personnes qui héritent de ce gène ont un risque à vie allant jusqu'à 80% de développer un cancer de l'estomac et jusqu'à 52% de développer un cancer du sein lobulaire.
Le gène code pour une protéine (cadhérine épithéliale) qui aide les cellules à adhérer les unes aux autres (l'une des différences entre les cellules cancéreuses et les cellules normales est que les cellules cancéreuses n'ont pas ces produits chimiques d'adhésion qui les font adhérer). Les cancers chez les personnes qui héritent de cette mutation sont plus susceptibles de métastaser.
PTEN
Les mutations du gène PTEN sont l'une des mutations du gène suppresseur de tumeur les plus courantes. Le gène code pour les protéines qui régulent la croissance des cellules et aide également les cellules à rester ensemble.
Les mutations du gène semblent augmenter le risque de rupture des cellules cancéreuses d'une tumeur et de métastases. Le PTEN est associé à un syndrome appelé syndrome de tumeur à hamartome PTEN ainsi qu'au syndrome de Cowden.
Les femmes porteuses d'une mutation PTEN ont un risque à vie de développer un cancer du sein jusqu'à 85%, et ont également un risque accru de modifications mammaires bénignes telles que la maladie fibrokystique, l'adénose et la papillomatose intraductale.
Les mutations sont également liées à un risque accru de cancer de l'utérus (et de fibromes utérins bénins), de cancer de la thyroïde, de cancer du côlon, de mélanome et de cancer de la prostate.
Les symptômes non liés au cancer comprennent une tête de grande taille (macrocéphalie) et la tendance à former des tumeurs bénignes appelées hamartomes.
STK11
Les mutations de STK11 sont associées à une maladie génétique connue sous le nom de syndrome de Peutz-Jegher. STK11 est un gène suppresseur de tumeur impliqué dans la croissance cellulaire.
En plus d'un risque accru de cancer du sein (avec un risque à vie allant jusqu'à 50%), le syndrome comporte un risque accru de nombreux cancers, dont certains comprennent le cancer du côlon, le cancer du pancréas, le cancer de l'estomac, le cancer de l'ovaire, le cancer du poumon, cancer de l'utérus, et plus encore.
Les conditions non liées au cancer associées à la mutation comprennent des polypes non cancéreux dans le tube digestif et le système urinaire, des taches de rousseur sur le visage et à l'intérieur de la bouche, etc. Le dépistage du cancer du sein est souvent recommandé pour les femmes à partir de la vingtaine et souvent avec IRM avec ou sans mammographie.
TP53
Le gène TP53 code pour des protéines qui arrêtent la croissance des cellules anormales.
Ces mutations sont extrêmement fréquentes dans le cancer, avec acquis des mutations du gène p53 se retrouvent dans environ 50 pour cent des cancers.
Les mutations héréditaires sont moins courantes et associées à des conditions connues sous le nom de syndrome de Li-Fraumeni ou syndrome de type Li-Fraumeni (qui présente un risque de cancer plus faible). La majorité des personnes qui héritent de la mutation développent un cancer à l'âge de 60 ans et, en plus du cancer du sein, sont susceptibles de développer un cancer des os, un cancer des surrénales, un cancer du pancréas, un cancer du côlon, un cancer du foie, des tumeurs cérébrales, une leucémie, etc. Il n'est pas rare que les personnes atteintes de la mutation développent plus d'un cancer primaire.
On pense que les mutations héréditaires du gène p53 représentent environ 1% des cas de cancer du sein héréditaire. Les cancers du sein associés à la mutation sont souvent HER2 positifs et ont un grade tumoral élevé.
Syndrome de Lynch
Le syndrome de Lynch ou cancer colorectal héréditaire sans polypose est associé à des mutations dans plusieurs gènes différents, notamment PMS2, MLH1, MSH2, MSH6 et EPCAM.
Le PMS2, en particulier, a été associé au double du risque de cancer du sein. Le gène fonctionne comme un gène suppresseur de tumeur, codant pour une protéine qui répare l'ADN endommagé.
En plus du cancer du sein, ces mutations comportent un risque élevé de cancers du côlon, des ovaires, de l'utérus, de l'estomac, du foie, de la vésicule biliaire, de l'intestin grêle, des reins et du cerveau.
Autres mutations
Il existe plusieurs autres mutations génétiques associées à un risque accru de développer un cancer du sein, et on s'attend à ce que d'autres soient découvertes dans un proche avenir. Certains d'entre eux incluent:
- BRIP1
- BARD1
- MRE11A
- NBN
- RAD50
- RAD51C
- SEC23B
- BLM
- MUTYH
Cancer du sein et tests génétiques
À l'heure actuelle, des tests sont disponibles pour les mutations du gène BRCA, ainsi que pour les mutations ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B et TP53, ce domaine devant s'étendre dramatiquement dans un proche avenir.
La disponibilité de ces tests soulève cependant de nombreuses questions. Par exemple, qui pourrait avoir un cancer du sein héréditaire et qui devrait être testé? Que devez-vous faire si vous testez positif pour l'un de ces gènes?
Idéalement, tout test devrait être effectué uniquement avec les conseils et l'aide d'un conseiller en génétique. Il y a deux raisons à cela.
La première est qu'il peut être dévastateur d'apprendre que vous portez une mutation qui peut augmenter votre risque, et les conseils d'une personne qui connaît la prise en charge et le dépistage recommandés sont inestimables.
Comme indiqué précédemment, certaines mutations confèrent un risque élevé et d'autres un risque beaucoup plus faible. Certaines mutations peuvent être plus préoccupantes plus tôt dans la vie (par exemple, dans la vingtaine), tandis que d'autres peuvent ne pas nécessiter de dépistage précoce. Un conseiller en génétique peut vous aider à connaître ce qui est actuellement recommandé en ce qui concerne le dépistage de votre mutation particulière tout en tenant compte de tout autre facteur de risque que vous pourriez avoir.
L'autre raison pour laquelle le conseil génétique est si important est que vous pouvez avoir un risque important de développer un cancer du sein même si vos tests sont négatifs. Il reste encore beaucoup à apprendre et un conseiller en génétique peut vous aider à examiner vos antécédents familiaux pour voir si vous présentez un risque élevé malgré les tests négatifs et planifier le dépistage en conséquence.
Tests génétiques pour le cancer du seinSoutien au cancer du sein héréditaire
Tout comme les personnes qui ont reçu un diagnostic de cancer du sein ont besoin de soutien, celles qui portent des gènes qui augmentent le risque ont besoin de soutien. Heureusement, il existe des organisations qui se concentrent spécifiquement sur le soutien des personnes dans cette situation.
Une organisation, FORCE, qui est l'acronyme de Facing Our Risk of Cancer Empowered, offre une ligne d'assistance, un babillard électronique et des informations pour ceux qui sont confrontés à un cancer héréditaire.
D'autres organisations et communautés de soutien sont disponibles pour aider les gens à faire face aux décisions liées à un diagnostic de cancer du sein héréditaire.
Le terme «précurseur» a été inventé par FORCE pour décrire les personnes qui survivent à une prédisposition au cancer du sein. Si c'est la situation à laquelle vous faites face, vous n'êtes pas seul, et en utilisant le hashtag #previvor, vous pouvez en trouver beaucoup d'autres sur Twitter et d'autres médias sociaux.
Un mot de Verywell
Il peut être difficile de se renseigner sur les nombreuses mutations génétiques différentes qui augmentent le risque de cancer du sein au-delà des mutations BRCA, mais ces «autres» mutations sont d'une importance significative sachant que les mutations BRCA représentent une minorité relative de cancers du sein familiaux. Dans le même temps, la science sur le cancer du sein héréditaire en est encore à ses balbutiements et il y a beaucoup à apprendre. Si vous craignez d'avoir une mutation ou si vous avez appris que vous en avez, il est utile d'en apprendre le plus possible. Les organisations de lutte contre le cancer héréditaire telles que FORCE peuvent non seulement vous fournir de plus amples informations, mais également vous aider à vous connecter avec d'autres personnes confrontées à un parcours avec des questions et des préoccupations similaires.