Contenu
- Avantages et inconvénients
- Recommandations de prescription
- Effets secondaires
- Interactions médicamenteuses
- Insuffisance hépatique
- Réactivation de l'hépatite B
- Pendant la grossesse
Mavyret a été approuvé le 3 août 2017 par la Food and Drug Administration des États-Unis pour une utilisation chez les adultes de 18 ans et plus. Les recherches suggèrent que le médicament peut atteindre des taux de guérison compris entre 92% et 100% selon le sous-type de VHC, un chiffre plus ou moins conforme à celui des autres antiviraux à action directe (AAD) actuellement utilisés dans le traitement de l'hépatite C.
Avantages et inconvénients
Mavyret est capable de traiter les six souches de VHC (génotypes) et peut être utilisé à la fois chez les personnes qui n'ont jamais été exposées aux médicaments anti-VHC et chez celles qui ont déjà échoué au traitement. De plus, le médicament peut être utilisé chez les personnes atteintes de cirrhose compensée (dans laquelle le foie est toujours fonctionnel).
Mavyret a un avantage clé par rapport aux médicaments similaires en ce sens qu'il peut traiter l'infection chronique par l'hépatite C en aussi peu que huit semaines. Tous les autres médicaments nécessitent pas moins de 12 semaines pour les patients nouvellement traités. Cela comprend le médicament combiné contre le VHC Epclusa qui est également approuvé pour les six génotypes.
Cependant, contrairement à Epclusa, Mavyret ne peut pas être utilisé chez les personnes atteintes de cirrhose décompensée (dont le foie ne fonctionne plus).
Un autre facteur de différenciation clé est le prix. Alors que des médicaments comme Epclusa ont un prix de gros d'environ 75 000 $ pour un cours de 12 semaines (ou 890 $ par comprimé), Mavyret est offert à 26 400 $ pour un cours de huit semaines (ou 439 $ par comprimé).
La différence de prix pourrait suffire à convaincre les assureurs maladie d'étendre le traitement aux 3,9 millions d'Américains infectés de façon chronique par le VHC, dont la plupart doivent attendre une insuffisance hépatique significative avant que le traitement puisse être approuvé.
Recommandations de prescription
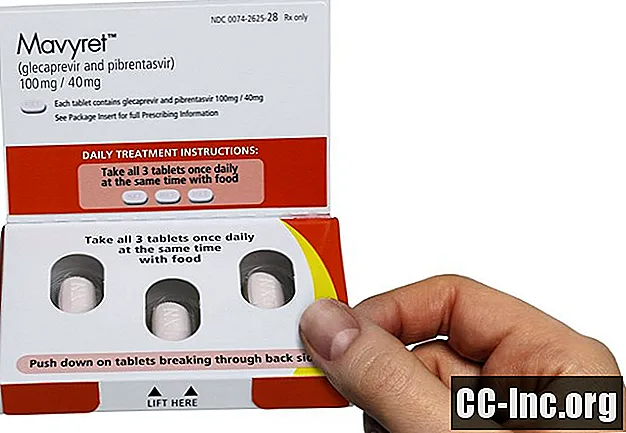
La posologie recommandée de Mavyret est de trois comprimés pris une fois par jour avec de la nourriture. Chaque comprimé contient 100 milligrammes de glécaprévir et 40 milligrammes de pibrentasvir. Les comprimés sont roses, de forme oblongue, pelliculés et gravés «NXT» sur une face.
La durée du traitement varie en fonction du génotype du VHC, de l'expérience du traitement et de l'état hépatique du patient, comme suit:
- Non traité auparavant sans cirrhose: huit semaines
- Non traité auparavant avec cirrhose compensée: 12 semaines
- Auparavant traité avec les génotypes 1, 2, 4, 5 et 6 du VHC sans cirrhose: huit à 16 semaines selon le traitement précédent
- Précédemment traité avec les génotypes 1, 2, 4, 5 et 6 du VHC avec cirrhose compensée: 12 à 16 semaines selon le traitement précédent
- Précédemment traité avec le génotype 3 du VHC avec ou sans cirrhose: 16 semaines
Environ 75% des Américains atteints d'hépatite C ont le génotype 1, qui est le plus répandu mais aussi le plus difficile à traiter. En revanche, entre 20 et 25% ont les génotypes 2 et 3, tandis que seule une petite poignée a les génotypes 4, 5 ou 6.
Effets secondaires
Les AAD de nouvelle génération comme Mavyret ont beaucoup moins d'effets secondaires que les thérapies de génération précédente, dont beaucoup comprenaient l'interféron pégylé (peginterféron) et la ribavirine. Les effets secondaires les plus courants associés à Mavyret (survenant chez plus de cinq pour cent des patients) comprennent:
- Mal de crâne
- Fatigue
- La nausée
- La diarrhée
D'une manière générale, les effets secondaires sont gérables et ont tendance à s'améliorer avec le temps.En fait, une étude préalable à la mise sur le marché a conclu que moins de 1% des personnes sous Mavyret ont arrêté le traitement en raison d'effets secondaires intolérables.
Interactions médicamenteuses
L'utilisation de médicaments à base de rifampicine, couramment utilisés pour traiter la tuberculose, est contre-indiquée pour une utilisation avec Mavyret et doit être interrompue avant le début du traitement. Ceux-ci incluent des médicaments avec les noms de marque Mycobutin, Rifater, Rifamate, Rimactane, Rifadin et Priftin.
D'autres médicaments sont connus pour interagir avec Mavyret et peuvent augmenter ou diminuer la concentration de Mavyret dans le sang. Les éléments suivants ne sont pas recommandés pour une utilisation avec Mavyret:
- Carbamepazine, utilisée pour traiter les convulsions et le trouble bipolaire
- Médicaments contraceptifs contenant de l'éthinylestradiol (œstrogène)
- Sustiva (éfavirenz) utilisé dans le traitement du VIH
- Atorvastatine, lovastatine et simvastatine utilisées pour traiter un taux de cholestérol élevé
- Millepertuis
Insuffisance hépatique
Mavyret est contre-indiqué chez les personnes présentant une insuffisance hépatique sévère (telle que mesurée par un score de Child-Pugh de C) et n'est pas recommandé pour les personnes présentant une insuffisance même modérée (Child-Pugh B).
Des tests de la fonction hépatique sont recommandés avant le début du traitement pour éviter les complications. Le score de Child-Pugh est également utile pour déterminer la gravité de la maladie hépatique sur la base de tests sanguins et d'un examen des symptômes caractéristiques.
Réactivation de l'hépatite B
Mavyret doit être utilisé avec prudence chez les personnes atteintes à la fois d'hépatite B et d'hépatite C. Le virus de l'hépatite B (VHB) est connu pour réactif pendant ou peu de temps après le traitement. La réactivation peut être accompagnée de symptômes de jaunisse et d'inflammation du foie. Si le traitement n'est pas arrêté immédiatement, la réactivation peut entraîner une insuffisance hépatique et même la mort.
Bien que l'infection par le VHB ne contre-indique pas l'utilisation de Mavyret, il faudrait une surveillance plus étroite des enzymes hépatiques pour identifier les premiers signes de réactivation.
Pendant la grossesse
Bien que Mavyret ne soit pas contre-indiqué pendant la grossesse, il existe peu de données cliniques humaines disponibles pour évaluer le risque réel. Cela étant dit, des études chez l'animal ont montré que l'utilisation du glécaprévir et du pibrentasvir pendant la grossesse n'est pas associée à des anomalies fœtales, y compris l'exposition pendant l'allaitement.
Une consultation spécialisée est recommandée non seulement pour peser les avantages et les risques du traitement, mais aussi pour aider à déterminer si le traitement est une question d'urgence ou quelque chose qui peut être retardé jusqu'après l'accouchement.
Pour éviter une grossesse pendant le traitement, il est conseillé aux couples d'utiliser au moins deux méthodes de contraception non hormonales pendant et jusqu'à six mois après la fin du traitement. Le contrôle des naissances à base d'œstrogènes n'étant pas recommandé, consultez votre médecin pour savoir si un contraceptif oral à progestatif seul peut être une option appropriée.
- Partager
- Retourner
- Texte